Was ist ein Antikörper?
Was ist ein Antikörper?
Antikörper-ProdukteBei Antikörpern, auch Immunoglobine (Ig) genannt, handelt es sich um große Y-förmige Proteine, des adaptiven Immunsystems. Zunächst werden Antikörper auf der Zelloberfläche als Transmembranrezeptoren der B-Lymphozyten präsentiert. Hierbei handelt es sich um eine Form von weißen Blutkörperchen. Im Knochenmark entsteht aus einer pluripotenten Stammzelle eine lymphatische Vorläuferzelle, woraus dann die B-Zelle heranreift. In Reaktion auf körperfremde Stoffe, auch als Antigene (= Antikörper-generierend) bezeichnet, können B-Zellen zu Plasmazellen differenzieren, welche in hohen Mengen lösliche Antikörper (ohne Transmembrandomäne) in die Körperflüssigkeiten sezernieren.
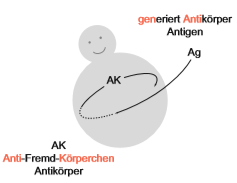 Abbildung 1: Antikörper-Antigen Schema (Schütt, C. & Bröker, B., 2011).
Abbildung 1: Antikörper-Antigen Schema (Schütt, C. & Bröker, B., 2011).
Antikörper haben zwei Funktionen: Sie erkennen einerseits verschiedenste Antigene mit sehr hoher Spezifität und Affinität und lösen andererseits immunologische Effektormechanismen gegen das erkannte Antigen aus (Schütt, C. & Bröker, B., 2011).
Antikörper werden sowohl in der Medizin als auch in der Biologie für diverse Anwendungen eingesetzt. In der Medizin werden sie z. B. als passiver Impfstoff, oder Therapeutikum in der Hämatologie, Onkologie oder bei der Behandlung von Autoimmunerkrankungen genutzt. In der Wissenschaft sie bei einer Vielzahl von Nachweisverfahren genutzt, wie z. B. bei Drogentests, ELISA , ELISPOT, EMSA FACS, Schwangerschaftstests und Western Blot (Antikörper, o. D.).
Wie ist ein Antikörper aufgebaut?
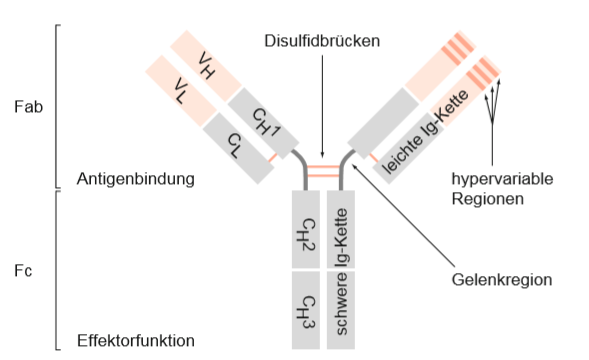 Abbildung 2: Struktur eines Antikörpers bzw. Immunglobulins am Beispiel von IgG. C: konstante Domäne; Fab: fragment of antigen binding; Fc: constant fragment; H: schwere Ig-Kette; L: leichte Ig-Kette; V: variable Domäne. (Schütt, C. & Bröker, B., 2011).
Abbildung 2: Struktur eines Antikörpers bzw. Immunglobulins am Beispiel von IgG. C: konstante Domäne; Fab: fragment of antigen binding; Fc: constant fragment; H: schwere Ig-Kette; L: leichte Ig-Kette; V: variable Domäne. (Schütt, C. & Bröker, B., 2011).
In Abbildung 2 wird modellhaft eine Struktur eines Antikörpers gezeigt. Durch kovalente Disulfidbrücken sind zwei identische schwere und zwei identische leichte Polypeptidketten miteinander verbunden und bilden die für Antikörper typische Y-förmige Struktur. Zwischen der ersten und zweiten konstanten Region der schweren Kette befindet sich eine Gelenkregion, welche die sog. Fab- und Fc-Fragmente verbindet (Schütt, C. & Bröker, B., 2011).
Sowohl die schweren als auch die leichten Ketten besitzen besitzen konstante (C-Region) und variable (V-Region) Regionen. Die leichten Ketten bestehen aus jeweils einer VL-Region und einer CL-Region, der Index steht für die leichten Ketten (L=light). Die schweren Ketten hingegen haben jeweils eine variable und 3 (IgG, IgA) bzw. 4 (IgM, IgE) konstante Domänen. Bezeichnet werden diese analog als VH und CH1, CH2, CH3 wobei hier das H (H=heavy) für die schweren Ketten steht (Antikörper, o. D.).
Die leichte Kette Während die Aminosäuresequenz der C-Region innerhalb einer Antikörperklasse nur geringfügig variiert (Fc-Fragment), ist die am Ende der Y-Arme liegende V-Region von Antikörper zu Antikörper sehr unterschiedlich (Schütt, C. & Bröker, B., 2011). Die variablen Domänen einer leichten und einer schweren Kette bilden die Antigenbindungsstelle (Antikörper, o. D.). Jeder Antikörper besitzt mindestens zwei Bindestellen, die gegen das Antigen gerichtet sind, das seine Produktion ausgelöst hat.
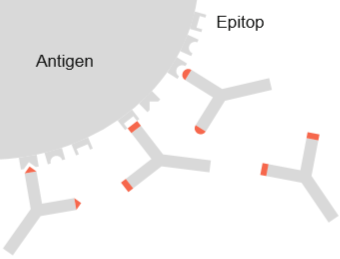 Abbildung 3: Antigen-Antikörper-Komplex (Schütt, C. & Bröker, B., 2011).
Abbildung 3: Antigen-Antikörper-Komplex (Schütt, C. & Bröker, B., 2011).
Antikörper erkennen kleine molekulare Strukturen auf der Oberfläche von Antigenen (Epitope) und können spezifisch an diese binden, es entsteht der sogenannte Antigen-Antikörper-Komplex.
Welche Wirkungsweisen haben Antikörper?
Bei Antigenen handelt es sich in den meisten Fällen um Proteine (z. B. von Viren und Bakterien), aber auch Lipide, Kohlenhydrate und andere Stoffe können eine antigene Wirkung zeigen. Eine Bindung von Antigenen durch Antikörper hat das Ziel, die in den Körper eingedrungenen Fremdstoffe zu inaktivieren und zu vernichten. Dabei gibt es verschiedene Mechanismen:
Bei der Neutralisation blockiert der Antikörper eine Stelle des Antigens, die dieses benötigt, um seine Wirkung entfalten zu können, wie beispielsweise das Erkennen und Eindringen in Körperzellen.
Durch das Anheften von Antikörpern an den Bewegungsapparat eines Eindringlings (z. B. die Geißel eines Bakteriums) kann dieser an der Bewegung gehindert (immobilisiert) werden.
Manche Fremdstoffe müssen vom Körper erst als solche markiert werden, um anschließend von Abwehrzellen erkannt und phagozytiert („gefressen“) werden zu können. Diese Markierung kann unter anderem durch Antikörper erfolgen und wird als Opsonisierung bezeichnet.
Unter Agglutination und Präzipitation versteht man zwei Prozesse, die zu einer Vernetzung bzw. Verklumpung von Antigenen durch Antikörper führen. Größere Antigen-Antikörper-Komplexe können von phagozytotischen Zellen besser erkannt und verdaut werden.
Antigen-Antikörper-Komplexe können von Komponenten des Komplementsystems erkannt werden, wodurch dieses aktiviert wird. Das Komplementsystem besteht aus ca. 25 verschiedenen Proteinen, die die Vernichtung von Antigenen, durch verstärken einiger bei einer Immunantwort auftretenden Reaktionen (Opsonisierung, Entzündungsreaktionen), unterstützen können (Murphy, K. & Weaver, C., 2018).
Welche Antikörperklassen gibt es?
Antikörper werden aufgrund ihrer Struktur, ihrer Verteilung im Organismus und in ihren Effektorfunktionen in verschiedene Klassen (Isotypen) eingeteilt. Alle Isotypen haben gemeinsam, dass sie eine große Varietät von Antigenbindestellen (Fab-Region) ausgeprägt haben. Die Immunglobulinklassen sind durch die konstanten Abschnitte der schweren Ketten charakterisiert, und man unterscheidet deshalb die fünf Immunoglobulin-Klassen: IgG, IgD, IgE, IgA und IgM. Weiterhin gibt es im Menschen zwei verschiede Typen von leichten Ketten κ und λ, und fünf verschiedene Typen von schweren Ig-Ketten, μ, δ, γ, α und ε. (Schütt, C. & Bröker, B., 2011).
Werden die verschiedenen Klassen verglichen, fällt auf, dass die Immunoglobuline IgG, IgD und IgE (Abbildung 4) recht ähnlich, als Monomere aufgebaut sind. Immunoglobulin A und Immunoglobulin M unterschieden sich durch ihren strukturellen Aufbau sehr auffällig von den anderen Klassen (vgl. Abbildung 4 und Abbildung 5).
Bei genauerer Betrachtung ist zu erkennen, dass alle Isotypen-Klassen Unterschiede in den schweren Ketten in der Anzahl der konstanten Domänen, der An- bzw. Abwesenheit von Gelenkregionen, der Anzahl und Lage der Disulfidbrücken aufweisen. Fünf oder sechs IgM-Monomere werden durch eine J-Kette zu einem Penta- oder Hexamer verbunden. IgA liegt meist als Dimer vor.
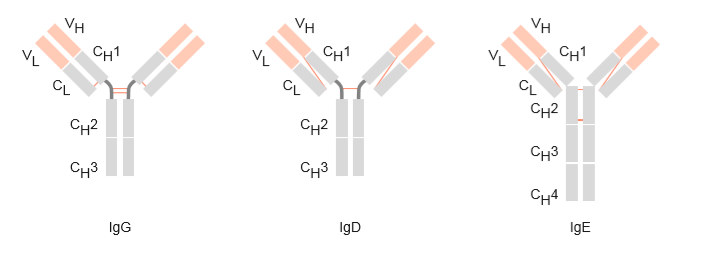 Abbildung 4: Struktureller Aufbau der Immunglobulinklassen IgG, IgD und IgE (Schütt, C. & Bröker, B., 2011).
Abbildung 4: Struktureller Aufbau der Immunglobulinklassen IgG, IgD und IgE (Schütt, C. & Bröker, B., 2011).
Immunoglobulin G - IgG (Monomer, schwere Kette: γ) ist der am häufigsten vorkommende Antikörper. Er zirkuliert in Körpersekreten wie Blut (ca. 75 % der Serumimmunoglobuline) und Lymphe und ist Bestandteil einer verzögerten Immunabwehr (Sekundärantwort) (Schütt, C. & Bröker, B., 2011). Bei wiederholter Infektion mit dem gleichen Erreger bildet der Körper schließlich IgG-Antikörper (IgG 2017). IgG hat eine ungefähre Halbwertszeit von drei Wochen und das ist einer der Gründe, weshalb es sich besonders gut zur Substitutionstherapie bei Antikörpermangel eignet. Es ist die einzige Immunoglobulin-Klasse, welche schon durch die Plazenta den kindlichen Kreislauf erreicht und so dem dem Neugeborenen einen ersten Immunschutz bieten kann. Zu den wichtigen Effektorfunktionen des IgG gehört die Neutralisation, d. h. IgG blockiert die Bindung des Antigens an seine Zielstrukturen.
Immunoglobulin D - IgD (Monomer, schwere Kette: δ) liegt nur in sehr geringen Mengen in Blut und Lymphe vor. Als Antigen-Rezeptor auf der Oberfläche von B-Lymphozyten fördert er deren Vermehrung und Differenzierung in Plasmazellen und unterstützt somit die Antikörperproduktion bei einer Infektion.
Immunoglobulin E - IgE (Monomer, schwere Kette: ε) macht nur einen kleinen Teil der gesamten Antikörpermenge aus und kommt in freier Form fast gar nicht in Blut und Lymphe vor. Das IgE-Molekül ist überwiegend auf der Oberfläche von Mastzellen (Zellen des Immunsystems, die Botenstoffe wie Histamin und Heparin speichern) und Basophilen (einer Art weißer Blutkörperchen) zu finden. Es spielt eine wichtige Rolle bei der Abwehr multizellulärer Parasiten, z. B. Würmern. Außerdem ist IgE für allergische Reaktionen vom Soforttyp verantwortlich (z. B. Heuschnupfen, allergisches Asthma, Insektengiftallergie, viele Lebensmittelallergien). Auf den Mastzellen und Basophilen fördert es bei Antigenkontakt die Ausschüttung von Histaminen und anderen entzündungsfördernden Stoffen, was unter anderem zu einer Erweiterung der Gefäße führt. Dadurch wird anderen Immunzellen ein Erreichen des Infektionsortes erleichtert (Schütt, C. & Bröker, B., 2011; Antikörper, o. D.).
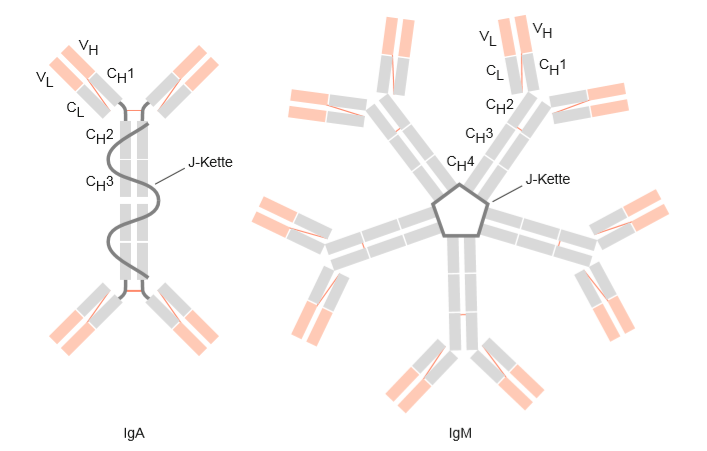 Abbildung 5: Struktureller Aufbau der Immunglobulinklassen IgA und IgM (Schütt, C. & Bröker, B., 2011).
Abbildung 5: Struktureller Aufbau der Immunglobulinklassen IgA und IgM (Schütt, C. & Bröker, B., 2011).
Immunoglobulin A - IgA (Dimer, schwere Kette: α) übernimmt durch seine Präsenz in Schleimhäuten die Funktion einer ersten Barriere für Eindringlinge. Sekretorisches IgA kommt zum Beispiel in der Tränenflüssigkeit, im Speichel, im Nasen- und Bronchialsekret, im Genitalsekret und in den Sekreten des Magen-Darm-Traktes vor. Außer in Schleimhäuten wird IgA auch von Drüsen im Umkreis mütterlicher Brustwarzen sezerniert und gelangt auf diesem Weg in die Muttermilch und den Säugling. Viele Fremdstoffe werden bereits durch IgA-Antikörper abgefangen und neutralisiert.
Immunoglobulin M - IgM (Pentamer, schwere Kette: μ) ist der Antikörper, der bei einer Infektion als erstes gebildet wird (Primärantwort). Alle naiven B-Zellen, d. h. solche, die noch keinen Antigenkontakt hatten, tragen IgM als B-Zellrezeptor auf ihrer Oberfläche; IgM ist deshalb das erste Immunglobulin, das im Verlauf einer Immunreaktion im Blut sezerniert wird. Durch seine Pentamer- bzw. Hexamer-Struktur weist das IgM 10-12 identische Antigenbindestellen auf, daher führen diese Antikörper zu einer starken Agglutination. IgM ist außerdem extrem effektiv in der Auslösung der Komplementaktivierung. Durch die Bindung eines einzigen IgM-Moleküls an sein Antigen, wird die Kaskade ausgelöst. Durch die Fixierung von Komplementfaktoren vermittelt IgM die Phagozytose des gebundenen Antigens, denn Makrophagen tragen auf ihrer Oberfläche viele Komplementrezeptoren. Nach einigen Wochen sinkt der IgM-Titer ab und wird von den in der Zwischenzeit gebildeten spezifischeren IgG-Antikörpern abgelöst (Schütt, C. & Bröker, B., 2011; Antikörper, o. D.).
Was sind Autoantikörper?
Kommt das Immunsystem aus dem Gleichgewicht und kann nicht mehr zwischen fremd und körpereigen unterscheiden, kann es zu einer Autoimmunität kommen. Das Immunsystem bildet nun gegen körpereigene Zellen, Gewebe oder Organe gerichtete Autoantikörper (auto = selbst) und autoreaktive T-Zellen. Der Angriff des Immunsystems gegen körpereigene Antigene (Autoantigene) kann als Autoimmunität beschrieben werden.
Als Folge können schwerwiegende Krankheiten, Autoimmunkrankheiten, auftreten. Zu den häufigsten Erkrankungen dieser Art zählen rheumatoide Arthritis, die mit einer Entzündung und Zerstörung der Gelenke einhergeht, die chronische Entzündung der Schilddrüse (Hashimoto-Thyreoiditis), die aufgrund der Zerstörung von Schilddrüsengewebe zu einer Unterproduktion von Schilddrüsenhormonen führt, und der Typ-1-Diabetes mellitus, der durch eine Zerstörung der Insulin produzierenden β-Inseln der Bauchspeicheldrüse gekennzeichnet ist (Rink et al., 2015).
Im Jahr 1957 wurden erstmal Autoantikörper (AAb) im Patientenserum gefunden, welche für Autoimmunerkrankungen verantwortlich gemacht wurden. Aus den heutigen Erkenntnissen geht hervor, dass ein in vitro-Nachweis organspezifischer Autoantikörper nicht ist mit einer kausalen Rolle in der Autoimmunerkrankung gleichzusetzen ist (Schütt, C. & Bröker, B., 2011).
Studien konnten belegen, dass AAb schon viele Jahre vor Ausbruch der zugehörigen Autoimmunerkrankung detektierbar sein können, ohne pathogenetisch wirksam zu sein. Weiterhin ist eine Manifestation der entsprechenden Krankheit nicht zwangsläufig (Autoantikörper, o. D.).
Autoantikörper stellen, unabhängig davon ob sie pathogenetisch wirksam, einen wichtigen Teil für die Früh- und Differentialdiagnostik, sowie zum Monitoring der Krankheitsaktivität von Autoimmunerkrankungen dar. Einige AAbs werden als diagnostische Marker-Antikörper genutzt, da sie vorwiegend nur bei einer bestimmten Erkrankung nachweisbar sind. Teilweise gelten bestimmte AAbs sogar als Klassifikationskriterium für eine definierte Autoimmunerkrankung, auch ohne hohe Spezifität (Autoantikörper, o. D.).
Antinukleäre Antikörper
Antinukleäre Antikörper (ANA) sind eine besondere Form von Autoantikörpern, die sich gegen Bestandteile der körpereigenen Zellkernstrukturen richten. Bei Verdacht auf entzündlich-rheumatische Erkrankung bzw. Kollagenose kann das Blut des Patienten auf ANA geprüft werden. Ursache erhöhter Werte können verschiedene Autoimmunerkrankungen sein (ANA a) o. D.; ANA b) o. D.).
Der Unterschied zwischen polyklonalen und monoklonalen Antikörpern
Polyklonale Antikörper richten sich gegen diverse Epitope eines Antigens. Sie werden erzeugt, in dem ein Tier gegen ein bestimmtes Antigen durch mehrfache Injektion immunisiert wird. Das Tier produziert Antikörper gegen das injizierte Antigen, hierbei handelt es sich um eine Antikörpermischung. Die Antikörper können sich im erkannten Epitop unterscheiden (siehe Abbildung 3). Die polyklonalen Antikörper können dann durch Aufreinigungsprozesse, wie zum Beispiel der Affinitäschromatographie, aus dem Serum isoliert werden.
Monoklonale Antikörper richten sich gegen nur ein bestimmtes Epitop eines Antigens. Für dessen Gewinnung muss zunächst wie bei den polyklonalen Antikörpern eine Immunisierung eines Tieres erfolgen. Anschließend werden dem immunisierten Tier Plasmazellen aus der Milz oder dem Lymphknoten entnommen.
Plasmazellen können sich jedoch nicht mehr teilen und müssen daher mit Tumorzellen hybridisiert werden. Die entstandenen Hybridoma-Zellen besitzen nun die Eigenschaft der Plasmazellen einen bestimmten Antikörper zu produzieren und zu sekretieren und zusätzlich die nahezu unendliche Teilbarkeit der Tumorzelle. So können die Hybridoma-Zellen vereinzelt und kultiviert werden. Ziel ist es einen Zellstamm zu erhalten, der auf eine einzige Hybridoma-Zelle, also eine einzige Plasmazelle zurückgeht. Alle Zellen einer Kultur entsprechen folglich einem Klon (monoklonal) zurück und produzieren einen identischen Antikörper mit genau definierbaren Eigenschaften wie bspw. die Bindestelle des Antigens, Bindungsstärke etc. (Antikörper, o. D.).
Chimäre Antikörper
Chimäre Antikörper, auch rekombinante Antikörper, sind spezielle monoklonale Antikörper die eine besondere Bedeutung in der Immuntherapie haben. Werden monoklonale Antikörper aus Tieren in der humanen Therapie eingesetzt, kann es zur anti-Antikörper Bildung kommen. Eine bessere Verträglichkeit wird erzielt, wenn chimäre, bzw. humanisierte Antikörper eingesetzt werden (Rink et al., 2015). Diese werden durch die Kombination der Immunoglobin-Gene zweier Spezien erzeugt. Die variable Region des Antikörpers des immuniserten Tieres wird dann mit der konstanten Region eines humanen Antikörpers fusioniert. Möglich ist es auch rein humane monoklonale Antikörper herzustellen, welche keine anti-Antikörper mehr induzieren (Chimäre Antikörper, o. D.; Rink et al., 2015).
Literatur
Antikörper. (o. D.). Chemie.de. Abgerufen am 03.09.2021 von https://www.chemie.de/lexikon/Antikörper.html#Anwendung_von_Antik.C3.B6rpern_in_der_Medizin
Antinukleäre Antikörper (ANA). a) (o. D.). Apotheken.de Abgerufen am 03.09.2021 https://www.apotheken.de/krankheiten/hintergrundwissen/5989-antinukleaere-antikoerper-ana basierend auf Schäffler, A. (2014). Gesundheit heute (2. Aufl.). Trias
Antinukleäre Antikörper (ANA). b) (o. D.). Gesundheit.GV.AT Abgerufen am 03.09.2021 https://www.gesundheit.gv.at/labor/laborwerte/autoimmun/antinukleaere-antikoerper
Chimäre Antikörper. (o. D.). Spektrum.de Abgerufen am 03.09.2021 https://www.spektrum.de/lexikon/biologie/chimaere-antikoerper/13443
IgG (IGG). (2017). Gesundheit.GV.AT Abgerufen am 03.09.2021 https://www.gesundheit.gv.at/labor/laborwerte/immunsystem/igg
Murphy, K. & Weaver, C. (2018). Immunologie (9. Aufl.). Springer-Verlag GmbH Deutschland
Rink, L., Kruse, A. & Haase, H. (2015). Immunologie für Einsteiger (2. Aufl.). Springer-Verlag GmbH Deutschland
Schütt, C. & Bröker, B. (2011). Grundwissen Immunologie (3. Aufl.). Spektrum Akademischer Verlag Heidelberg.
Was sind Autoantikörper. (o. D.). IMD Labor Berlin Abgerufen am 03.09.2021 https://www.imd-berlin.de/spezielle-kompetenzen/autoimmunerkrankungen/autoantikoerper.html



